Naturen har brukt tre milliarder år på å bygge det livet vi kjenner. Lang tid, men så er også resultatet blitt fantastisk. Men det har ikke alltid vært slik som vi kjenner det.
I de 2,4 første milliardene år var livet encellede organismer. Det var i den såkalte kambriske eksplosjonen at cellene slo seg sammen og dannet høyerestående liv.


I løpet av årmilliardene har livet fylt alle mulig tilgjengelige nisjer på jorden. Om og om igjen etter hvert som artene har avløst hverandre.
Til og med under jorden finnes det liv, og enkelte mener nå at mengden av biologisk liv er større under jorden enn over.
Naturen fortsetter å forbløffe oss og vi har bare begynt på lærekurven. Men mens vi fortsetter å lære om livets utvikling er det mange som nå mener de kan gjøre det samme på nytt. Vi har jo mye av oppskriften.
Hvorfor kan vi ikke bygge liv selv? Skreddersydde livsformer med egenskaper som er tilpasset våre behov.
Biorock
Forskere over hele verden jobber nå med slike ideer. Selvfølgelig er det ikke snakk om nye husdyr, som kyr hvor alle musklene er indrefilet, men om de aller enkleste organismene slik som bakterier.
Den som virkelig fikk blest om ideen i fjor var mannen som er omtalt som biologiens rockestjerne, Craig Venter.
Han kom for første gang i det store rampelyset da han fikk fart på sekvenseringen av det menneskelige genom (DNA-molekylets sammensetning) i år 2000.
Det hadde vært et stort internasjonalt prosjekt som sneglet seg av gårde før Venter & Co kom inn fra sidelinjen med sin nye teknikk basert på bruk av massiv datakraft.
Et annet direkte resultat av denne teknologien er at vi i dag har fullstendig sekvensert og kartlagt arvematerialet av mer enn 1000 ulike bakteriearter.
Lage drivstoff
Etter å ha sekvensert en rekke arter, inklusive seg selv, vil nå Venter lage en organisme som produserer biodrivstoff. Han vil dyrke slike organismer i enorme tanker hvor de mates med sollys og CO 2 og så å si svetter ut drivstoff.
.png)
.jpg)
Ideen er intet mindre enn en form for fotosyntese som skal konkurrere ut dagens fossile oljeindustri. I resten av verden arbeides det for fullt med å lage annengenerasjons biodrivstoff.
Det Venters selskap jobber med er karakterisert som fjerde generasjon. Lykkes de kan det se mørkt ut for oljeboring i Lofoten, og for langvarige norske inntekter.
Lang utvikling
Da det for alvor løsnet for bioteknologien på midten av 70-tallet var det nettopp målrettet modifikasjon av naturen som var ideen.
Man fant ut hvordan man kunne klippe løs et gen fra en organisme ved hjelp av såkalte restriksjonsenzymer og plassere det inn i andre organismer ved bruk av såkalte plasmider, som er små sirkulære DNA-molekyler.
Plutselig åpnet det seg et hav av muligheter. Bakterier begynte å produsere menneskelig insulin og andre farmasøytiske produkter, og vi kunne modifisere planter og dyr for å gi dem nye ønskede egenskaper.
I praksis er dette omtrent det naturen selv gjør gjennom evolusjonen, men i hurtigfilm.
Syntetisk liv
Nå vil mange, med Venter som den mest profilerte, ta et langt steg videre. Man ønsker å bygge nytt liv med spesielle egenskaper. Gevinstene kan bli fantastiske.
Nye energikilder, ny medisinsk teknologi, nye måter å bli kvitt forurensninger og biologiske datamaskiner, er bare noen få av visjonene.
Men mange er naturlig nok bekymret for konsekvensene. Hva vil skje om våre nye konstruerte ”husdyr” slipper fri og begynner å formere seg og mutere ute i naturen.
Svaret fra biologene som jobber med slike organismer er at de ørsmå spesialbygde bakteriene har en svært liten livsnisje og bare kan leve under helt spesielle betingelser tilrettelagt på laboratoriet.
Det er også mulig å bygge inn en slags selvmordsmekanisme. Spesielle egenskaper, slik som at de må få tilførsel av spesielle aminosyrer for å overleve. Slike tiltak vil sikre at de ikke vil overleve i det fri.
Ved industriell produksjon dyrkes bakteriene i lukkede bioreaktorer og destrueres etter bruk. Noen vil mene at det vil alltid være en risiko og her må det være en balanse mellom nytte og mulige skadeeffekter.
I starten
Veien mot syntetisk liv vil være en lang prosess. Man bygger videre på det man har lært i bioteknologien om å sette inn nye gener i en organisme for å endre cellens egenskaper i en bestemt ønsket retning.
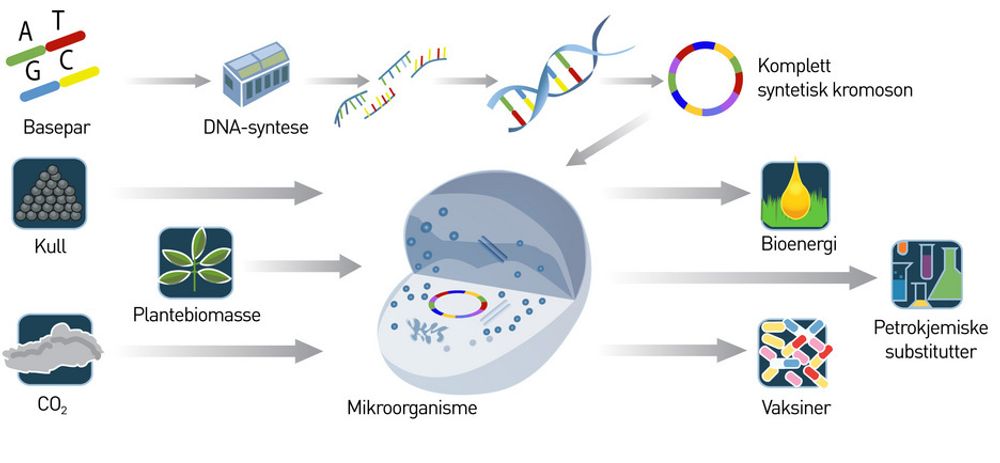
Fra det at man på 70-tallet lærte å sette inn et gen klarer man i dag å sette inn mange gener i en mikroorganisme med såkalt rekombinant DNA-teknikk. Det nye nå, er det som kalles DNA-syntese.
I stedet for å hente gener fra andre organismer kan man syntetisere dem i laboratoriet. Genene kan designes og skrives på en PC, og så gjør en maskin den fysiske byggeprosessen.
Ved hjelp av såkalt gensyntese har Venters forskningsgruppe bevist at de nye genene kan settes sammen i en bestemt rekkefølge slik at de danner en sirkel, akkurat som arvematerialet i en bakterie. Så kan det nye arvematerialet transplanteres inn i en bakterie som er ”tømt” for sitt eget.
Den er redusert til et biologisk ”rom” som kan fylles med nytt syntetisk arvemateriale til dannelse av nytt liv med nye egenskaper. En bakterie har, i motsetning til plante- og dyreceller, kun ett kromosom og ingen cellekjerne.
I stedet flyter arvestoffet fritt inne i bakteriene og i sum gjør dette at de er mye enklere å arbeide med.
Den mest aktuelle bakterien til dette bruket, heter Cyntia og er vanligvis årsak til urinveisinfeksjoner. Craig Venter har vist at dette er en god ”grunnmur” til å bygge nye syntetiske organismer på som produserer de ønskede stoffene.
Naturlige bakterier som karosseri
En alternativ og mindre dramatisk strategi enn den Venter bruker er å bruke naturlige gunstige bakterier som ”karosseri” for syntetisk biologi.
Syntetiske gener kan lages og anvendes for å erstatte naturlige gener og så bygges inn i det naturlige arvematerialet får å lage helt nye egenskaper. Man lykkes ikke alltid like godt når man henter gener ut fra naturen og setter den inn i mikroorganismer.
Håpet er at man vil lykkes bedre ved å bruke syntetiske gener med de samme egenskapene.
Et godt eksempel på en slik anvendelse av syntetisk biologi er utvikling av gjærceller som kan produsere den viktige malariamedisinen Artemesinin.
D enne medisinen kan ekstraheres fra en plante, men det er veldig kostbart. I stedet er i alt 14 ulike gener med opphav fra planten modifisert og satt inn i gjærcellen og resultatet er en mye mer effektiv prosess for produksjon av denne medisinen.
Kilder: Leder i Bioteknologinemnda, Sissel Rogne, og Seniorforsker i SINTEF, Trygve Brautaset.