Tekst: Rolf Skatvedt, Trainor Automation AS


Naturgass er i utgangspunktet en fargeløs, gift- og luktfri gass som er lettere enn luft. Den, eller rettere sagt de, består i hovedsak av forbindelser mellom hydrogen- og karbonatomer.
Starter med metan
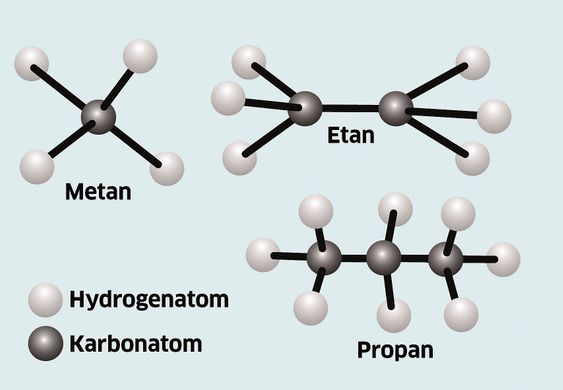
Det enkleste hydrokarbonet vi kjenner består av ett karbonatom og fire hydrogenatomer. Formelen blir derfor CH4. Det norske navnet er metan. Den neste i rekken er etan (C2H6). Dette gir oss en generell formel for rene mettede hydrokarboner: CnH(2n+2).
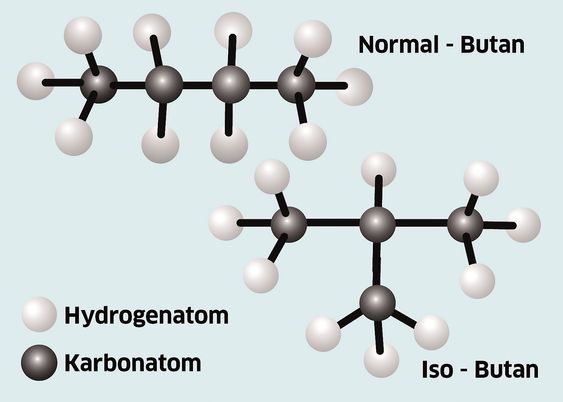
For metan blir formelen da n=1 og for etan blir den n=2. Ved butan og høyere antall karbonnummer er det muligheter for forgreininger i kjeden. Med fire karbonatomer kan vi få to typer, nemlig iso butan og normal butan.
Kan være komplekse
Fem karbonatomer i skjelettet gir tre mulige forgreininger, og seks karbonatomer gir åtte mulige forgreininger. Ved ytterligere økning av karbonantallet vil også antall forgreininger øke, og vi får mange forskjellige stoffer med samme antall karbonatomer.
I tillegg får vi sykliske forbindelser og aromater, så naturgass kan ha svært kompliserte sammensetninger. Generelt kan vi si at når flere karbonatomer slår seg sammen dannes mer komplekse HC-molekyler (hydrokarbon) med større masse og energi.
Like, men ulike


Det er verdt å merke seg at også molekyler med lik fordeling av HC-atomer kan ha forskjellige fysiske egenskaper, eksempelvis ulikt energiinnhold, som en konsekvens av forskjellig sammenkopling eller forskjellige bindinger.
Eksempler på fysikalske verdier koplet til forskjellige hydrokarboner er:
- Hydrogenatom (H2) har en molvekt, eller masse, tilnærmet to (det vil si at ett mol antall hydrogenatomer veier ca to gram)
- Karbonatom (C) har en molvekt, eller masse, tilnærmet tolv (det vil si at ett mol antall karbonmolekyler veier ca tolv gram)
- Metan (CH4) har en molvekt, eller masse, tilnærmet lik 16 (det vil si at ett mol antall metanmolekyler veier ca 16 gram) og har brutto energiinnhold på 37,7 MJ / Sm3.
- Butan (C4H10) har en molvekt, eller masse, tilnærmet lik 58 (det vil si at ett mol antall butanmolekyler veier ca 58 gram) og har brutto energiinnhold på 121 MJ / Sm3.
Aromatiske varianter
Vi skal senere i artikkelserien se på hvordan vi kan beregne fysiske størrelser som molvekt eller molmasse, densitet, brennverdi, lydhastighet, etc. til naturgass ved hjelp av data og formler vi finner i internasjonalt aksepterte standarder, eksempelvis ISO 6976.
Aromatiske forbindelser er hydrokarboner bygget opp av lukkede, umettede ringer av hydrokarboner med en generell formel: C n H 2n - 6 . I tillegg til disse forekommer også hydrokarboner med høyere antall karbonatomer, ja helt opp til flere tusen (Cellulose).
Og så noen spesialiteter

I naturgass finnes det også små gassmengder av uorganisk art som for eksempel hydrogensulfid (H2S), nitrogen (N2), samt noe karbondioksid (CO2) og vanndamp (H2O). Naturgass er normalt mettet med vanndamp når den produseres fra et reservoar eller en brønn.







