Mye av batteriforskningen handler om å få plass til mest mulig energi. Det vil si å få flest mulig negativt ladede elektroner, med høyest mulig spenning, til å gå i den ytre kretsen på hver opplading. Elektronene går fra den negative anoden til enheten som bruker strøm, og ender i den positive katoden. For at det skal kunne skje må positive litiumioner bevege seg fra anoden via elektrolytten til katoden. Når batteriet lades i stedet for å belastes, det vil si tvangsfôres med elektroner fra den ytre kretsen, reverseres retningene slik at litiumionene tvinges tilbake til anoden.
Poenget er at litiumionene «liker seg ikke» i anoden. De vil svært gjerne tilbake til katoden.
For at det skal skje må det gå elektroner i den ytre kretsen. Da kan et tilsvarende antall litiumioner «slippe ut av fangenskap» og vandre tilbake fra anoden til katoden.
Hvordan litiumioner vandrer mest effektivt er særdeles viktig i batterier. De må kunne bevege seg med enkelhet inne i begge elektrodene og mellom dem gjennom elektrolytten. Det krever best mulig ledningsevne for ionene, samtidig som elektrolytten ikke skal lede elektroner. Dette har med både kjemi og fysikk å gjøre, som materialiserer seg i materialteknologi.
Katoden
En lang rekke grunnstoffer og kombinasjoner av dem benyttes for å lage en god katode. I elbiler i dag benyttes ofte såkalt NCM materialer i ulike kombinasjoner. Bokstavene står for Nikkel, Kobolt og Mangan. Nikkel, og i enda større grad kobolt, er dyrt, og det siste er kontroversielt fordi det er vanskelig å forsikre seg om at det ikke stammer fra barnearbeid i gruver i Kongo. Litt mer nikkel gir også litt høyere spenning i batteriet. Derfor har miksen av de tre metallene variert fra like mye av hvert til den seneste teknologien som bruker 80 prosent nikkel, ti prosent kobolt og ti prosent mangan. Alle metallene er bundet til et oksygen og er oksider.
Det jobbes med katodematerialer som bruker mindre nikkel og ikke noe kobolt. Målet er å oppnå lavere materialkost og høyere energitetthet samtidig.
Jernfosfat-batterier
Teslas nye batterisamarbeid med den kinesiske batterigiganten CATL er etter alle solemerker basert på jernfosfatkjemi. Den kan vise seg å ikke inneholde nikkel og kobolt og samtidig ha løst utfordringene med lavere spenning og energitetthet. Slike batterier degraderer også mye saktere enn litiumionebatterier. Nesten alle elektriske busser i Kina benytter jernfosfatbatterier.
Svovelkatode
En radikal løsning, både på materialkostnader og evnen til å lagre strøm, er å bytte ut metalloksidene med svovel. Svovel er svært billig, det er lett og kan lagre mer strøm enn metalloksider. Dessverre er det ikke lett å bytte. Håpet er at de kan lagre fra tre til fem ganger så mye strøm som i litiumionebatterier, men det er i så fall lenge til. Svovel introduserer et helt nytt sett av materialproblemer.

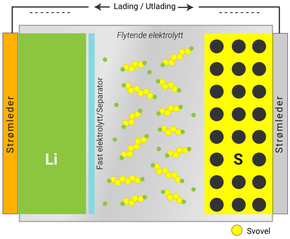
Svovel har liten ledningsevne, noe det har felles med oksidene. Derfor må svovelet ha hjelp fra andre elementer slik at elektronene kan ledes fram og tilbake. En eller annen form for karbon peker seg ut til denne jobben. Svovelbaserte katoder har også det problemet at svovelet sveller opp når det binder seg til litium. Det norske nyetablerte selskapet Morrow Batteries tror en innkapsling av svovel i grafén løser både problemet med ledningsevne og at det gir plass til svellingen. I tillegg slipper man at svovelet blir med gjennom elektrolytten og bryter ned anoden. Verre er det at svovel lager negativt ladede ioner som kan gå feil vei i batteriet, og setter opp en «shuttle» som tømmer batteriet for ladning. Her kan faststoffelektrolytter eller andre barrierer hjelpe. Til slutt er det HMS-utfordringene med svovel i batteribranner, som også trenger gode løsninger.
Anoden
Anoden er omtrent den samme på svovel- og litiumionebatterier. Den tradisjonelle anoden er bygget av grafitt. Det fungerer veldig bra, med god ledningsevne og egenskaper for å holde fast i litiumionene. Problemet er at grafitt har begrenset evne til å holde på mange litiumioner.
Silisium er svært mye bedre. Mens det trengs seks karbonatomer til å holde på et litiumion, så kan et silisiumion holde på 3,75 litiumioner. Litt av fordelen forsvinner ved at Si har over dobbelt så stor atomvekt, men teoretisk er det fremdeles en faktor 10 i forskjell.
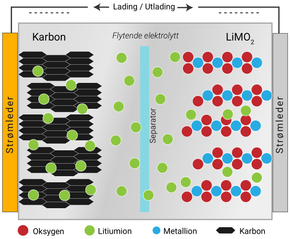
Mange moderne batterier inneholder silisium i varierende grad. Utfordringen er at silisium sveller opp når det knytter seg til litiumionene. Likevel er målet å øke anodeinnholdet av silisium fordi gevinsten er så stor. Det arbeides med flere teknologier for å skape plass til at silisiumet utvider seg når det binder seg til litiumioner. En måte kan være å kapsle inn Si i baller av grafén. Det gir også økt ledningsevne som er en bonus.
I et svovelbatteri hvor svovelet også sveller når det binder seg til litium vil det være en slags balanse der katoden sveller når anoden gir fra seg litium og omvendt.
Den siste anodetypen inneholder litium metall. Her får man de største gevinstene i form av energitetthet. Litiumioner trives dårlig i nærheten av mer litium, derfor blir spenningen høy, men det er vanskelig å kontrollere hvor litiumet legger seg. Litium trenger også plass og man må utvikle teknologi som kan gi nok plass til alle litiumionene som vil feste seg på litiummetallet, i pene lag, og ikke som utstikkere – kalt dendritter – som kan kortslutte batteriet på innsiden.
I en flytende elektrolytt får de positive litiumionene hjelp av minusladede «kompiser», f.eks. heksafluorfosfat, PF−6, som hjelper dem med vandringen gjennom elektrolytten fra katoden til anoden. Det gir netto null lading i elektrolytten, så det er forskjellen i konsentrasjon, og ikke lading, som gjør at vandringen diffunderer riktig vei. Det er først i grenseflatene spenningen virkelig har noe å si.

– Norsk gass har fått en økt geopolitisk betydning
Fast elektrolytt
Batterier med fast elektrolytt kan løse mange problemer med dagens flytende elektrolytter. De skal lede Li+ uten å lede elektroner, men uten utfordringene med giftighet og brennbarhet. Fast elektrolytt kan også hjelpe til med å realisere svovelbaserte batterier fordi problemet med svovel-shuttle-ioner blir borte. De siste gjennombruddene i faste elektrolytter har vært sulfider, som er mykere enn oksider og dermed gir bedre kontaktflater mot katode og anode.
Det finnes en lang rekke typer faste elektrolytter. Mange er basert på ulike polymerer og keramer. De fleste krever høyere temperatur enn romtemperatur for å lede godt nok, men tåler til gjengjeld også mye høyere temperatur uten å bli ødelagt, eller ta fyr. Dermed kan batterimodulen cellene er pakket i bli lettere, fordi kjølesystemet blir mye enklere, selv om cellene ikke har fått mere energi.
Mer spenning
En ulempe med svovel i katoden er den lave spenningen. Den er på 2,1 volt, omtrent halvparten av dagens litiumionebatterier. Likevel er potensiell lagringskapasitet stor fordi antallet amperetimer er så høyt at man likevel får høyere antall wattimer. Mens litiumionebatterier i dag er på rundt 250 Wh per kilo så er det demonstrert svovelbatterier på mer det dobbelte – men det forutsetter at anoden er en Li-metall-anode. Ny teknologi på katoden til litiumionebatterier kan øke spenningen til 5 volt og i så fall går ladekapasiteten opp rundt 20 prosent. Mer silisium, og eventuelt litium metall vil også gi mer kapasitet i anoden. Det betyr at vi også vil få mye mer ut av litiumionebatteriet om noen år.
Selv om svovelbaserte batterier høres fantastiske ut, og at slike batterier kanskje kan bli sikrere og billigere, er det mange problemer som gjenstår å løse. Det største er nok antall ladesykler som foreløpig er så lavt at teknologien ikke kan benyttes i biler. Hvis svovelbatteriene både trenger faststoffelektrolytt og litium-metallanoder for å ha et fortrinn, kan det ta lang tid før Li-ion-batteriet er utkonkurrert.
Kilde: Teknologisjef i Cenate, Martin Kirkengen

Forskere: Teknologien kan femdoble effekten fra jordvarme








