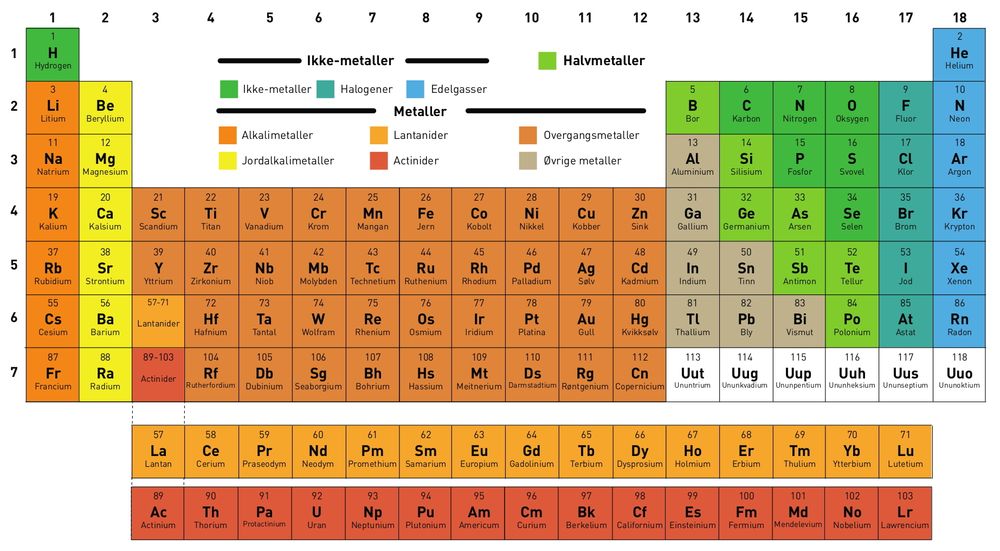
Dimitri Mendelejev ordnet de 65 grunnstoffene som var kjent i 1869 i en tabell som ligner på dagens. Han brukte det han visste om grunnstoffene og deres kjemiske forbindelser og listet grunnstoffene etter økende atomvekt, kan vi lese i Store Norske Leksikon.
Kjemien er av mange kalt «den sentrale vitenskap», fordi den binder sammen så mange av de andre vitenskapsgrenene. Kjemien er selve navet i mange naturvitenskaper fordi den forklarer hvordan stoffene er bygget opp og reagerer med hverandre. Vi ville ikke hatt verken moderne biologi, geologi, materialteknologi eller fysikk uten kjemi.
Grenseland
Skal vi forstå kjemi, må vi helt til bunns i materien i det mange kaller fysikalsk kjemi. Her i grenselandet mellom fysikk og kjemi ligger nøkkelen til forståelse. Her står kvantemekanikken sentralt og forklarer hvordan atomene fungerer alene og i samspill med hverandre.

Kunnskapen om kjemi ble gradvis etablert gjennom mange hundre år, men det var først på 1900-tallet vi forsto mekanismene bak kjemiske bindinger. Da kvantemekanikken kom, var den sterkt etterlengtet fordi man plutselig kunne forklare det man hadde observert lenge. Man hadde skjønt at kjemiske bindinger gav en energigevinst, men nå forsto man hvordan den oppsto.
Ionebindinger

Oppdaget store sprekker i ti år gammel tunnel – slik skal den sikres
Den klassiske bindingen i salter var den letteste å forstå ved at ladninger tiltrekker hverandre. Ioner er atomer eller molekyler som har tatt opp eller avgitt ett eller flere elektroner slik at det er oppstått en elektrisk ladning. Vi vet at natrium og klor i vanlig koksalt, binder seg til hverandre som ioner; Na+ og Cl-. De danner gittere i form av krystaller gjennom slik tiltrekning.
Kovalente bindinger
Mens det er lett å forstå at ulike ladninger tiltrekker hverandre, er det vanskeligere å forstå hvorfor to atomer henger sammen. Hvorfor binder for eksempel to hydrogenatomer uten noen ladning seg til hverandre? Hvilke krefter som virket her var ikke lett å forstå før kvantemekanikken forklarte det.
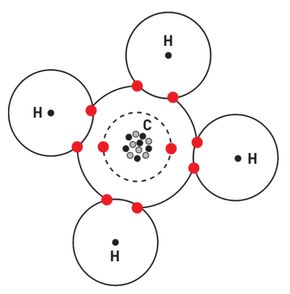
Det var Gilbert N. Lewis som først fant ut at det var en energigevinst når to slike atomer fant sammen i par. Den klassiske måten å se et atom på er at elektronene går rundt kjernen som planeter rundt sola. Det er bare delvis korrekt fordi det ikke er mulig å vite hvor elektronene er. Posisjonen kan bare beregnes statistisk. Lewis fant ut at selv om tiltrekningen og frastøtningen mellom to hydrogenatomer tilsynelatende balanserer, så er tiltrekningen likevel større når de slår seg sammen i et H2-molekyl.
Når det skjer, er det fordi det oppstår en større elektrontetthet i aksen mellom de to atomkjernene (to protoner i hydrogen) og det skaper tiltrekning. Dette er den samme kraften som holder de fleste molekyler sammen.
Trang til å henge sammen
Det er ikke bare kjemiske bindinger som forklares gjennom kvantemekanikken. Samme teori forklarer så ulike egenskaper som elektrisk og termisk ledningsevne i metaller, og til og med fargen til ulike stoffer.
Med kovalens oppnår molekylet samverdi eller synergi. Det indikerer at to atomer har en felles interesse av å henge sammen. Denne trangen til å henge sammen skyldes hvordan naturen har bygget atomet. Rundt kjernen finner vi elektronene, men ikke hvor som helst. De er fordelt rundt kjernen i såkalte skall. Jo lengre ut fra kjernen, jo høyere energi har elektronene. Det ytre skallet kan ha fra et til åtte elektroner. Men det er først når skallet har to eller åtte elektroner at det er fullt. Edelgassene som vi finner helt til høyre i det periodiske systemet har fulle elektronskall og vil ikke reagere med andre stoffer.
De atomene som ikke har to eller åtte elektroner i ytre skall, som vi kaller valensskallet, kan inngå bindinger med andre atomer slik at de til sammen oppnår dette. Kreftene i alle atomer vil ha et fullt valensskall, og om de ikke er edelgasser, vil de reagere med andre stoffer for å få det.

Forklarer mørk materie med sokkemetafor
Sterke og svake
Karbon har f.eks. fire elektroner i ytre skall. Ved at et karbonatom reagerer med fire hydrogenatomer slik at det dannes metan CH4, får både karbonatomet og hydrogenatomene fylt opp sine valensskall.


Karbonatomet får sin oktett og hydrogenatomene får sine duetter. Det som gjør om et stoff er sterkt eller svakt bundet er måten kreftene mellom naboatomene virker. I metan er alle skall ferdig oppfylt. Karbon danner også svært sterke bindinger med seg selv, f.eks. i to dimensjoner som i grafitt eller i tre dimensjoner som i diamant. I begge tilfeller får karbonatomene fylt opp sine ytre skall til åtte.
Diamant og hydrogen har perfekt kovalente bindinger, hvor atomene som er sammenbundet står for halvparten av elektronene hver. I andre stoffer er elektronfordelingen mer skjev; jo skjevere fordeling, jo mer ionisk er bindingen.
Hydrogenbindinger
Vann er et spesielt stoff fordi det er så viktig for liv og, fordi det opptrer i tre faser i vårt miljø, som is, vann og vanndamp. I vann og is er det såkalte hydrogenbindinger som binder molekylene sammen.
Elektronskyen som ligger mellom oksygen og hydrogenatomet ligger litt nærmere O enn H. Det gjør hydrogenet litt positivt og oksygenet litt negativt, og på den måten tiltrekker nabomolekylene hverandre. Stoffer med slike bindinger har derfor et høyere kokepunkt enn de ellers ville hatt.

Olympiatoppen og Madshus står bak: De skal lage verdens raskeste ski
Metaller
Metaller er et slags særtilfelle av kovalente bindinger. I metaller deler mange atomer de samme elektronene i det ytre skallet, og de blir et slags felleseie. Det gjør at de lett kan bevege seg elektriske felt.
Hvis vi har en elektronkilde i den ene enden av et metall og et sted med elektronmangel i den andre enden, vil de inngå i en elektrisk krets ved at atomene samtidig avgir og opptar elektroner.

Soleksplosjoner kan avsløre flere mysterier
Hovedinnholdet i denne artikkelen ble publisert første gang i Teknisk Ukeblad nr 13/2011, i forbindelse med det internasjonale kjemiåret. Hovedkilde: Professor Einar Uggerud.