Kakeksi kalles den, avmagringen og kraftløsheten og den elendige helsetilstanden som følger etter lang tid med svulstens stimulering av muskelnedbrytning i kroppen.
– Svulsten kan sitte et helt annet sted enn der muskelcellene blir påvirket, sier Geir Bjørkøy, professor ved Institutt for bioingeniørfag, Fakultet for naturvitenskap ved NTNU.
– En liten kreftsvulst, godt gjemt i lungene eller bukspyttkjertelen din kan føre til at musklene dine blir mindre og svakere. Eller at pustingen din blir dårligere. Eller hvor godt hjertet ditt slår, oppsummerer Kristine Pettersen, postdoktor ved Senter for Molekylær Inflammasjonsforskning (CEMIR) ved NTNU.

– Avstanden fra svulsten til området som blir påvirket, betyr at det må finnes en forbindelse mellom svulsten og de muskelcellene som blir ødelagt. Dette må være en, eller flere fysisk substans(er) fra svulsten som får muskelcellene til å øke nedbrytingen av seg selv ut over det som er normalt, sier senioringeniør Sonja Andersen ved Institutt for bioingeniørfag.
Nå har en forskergruppe ved blant annet NTNU identifisert en mulig mekanisme for hvordan kreftcellene kan sende beskjed til muskelcellene. De spennende resultatene er publisert i Journal of Cachexia, Sarcopenia and Muscle (JCSM).
Mange dør av muskeltapet
Kakeksien blir nesten som en egen sykdom i tillegg til kreften selv. Når muskelcellene dine brytes ned, blir du ikke bare mer kraftløs, men du tåler i tillegg ikke den tøffe kreftbehandlingen like godt.
Folk med kakeksi kan gå kraftig ned i vekt og det er vanskelig å motvirke tapet med økt næringsinntak alene. Pasientene blir gjerne både trøtte og kvalme.
Rundt 30 prosent av alle kreftpasienter som dør, gjør det antakelig som følge av kakeksien, og ikke av selve kreftsykdommen. Og det finnes per i dag ingen effektiv behandling av kakeksi.
- Les også: Her lager forskere små hjerner av hud
To hovedmistenkte var begge skyldige
Kreftcellene må altså gi muskelcellene beskjed om å bryte seg ned. Spesielt to signalstoffer har tidligere hatt status som mistenkte i denne sammenhengen.
De hovedmistenkte har vært activin A og interleukin 6 (IL-6). Noen studier har vist at activin A må være viktig, mens andre har påvist at IL-6 er et helt sentralt signalstoff fra svulsten som får muskelcellen til å bryte seg ned.
– Vi har selv vist tidligere at IL-6 kan øke nedbrytningsprosessen i muskelceller, og dermed kan være viktig for utviklingen av kakeksi, sier postdoktor Pettersen.
Men hvem har mest rett? De som skylder på activin A, eller de som mener IL-6 er viktigst?
– Begge. Både activin A og IL-6 er sentrale signalstoffer, konstaterer professor Bjørkøy.

Biler med sensorer kan avsløre skader på broer
Dette er kortversjonen av det som foregår:
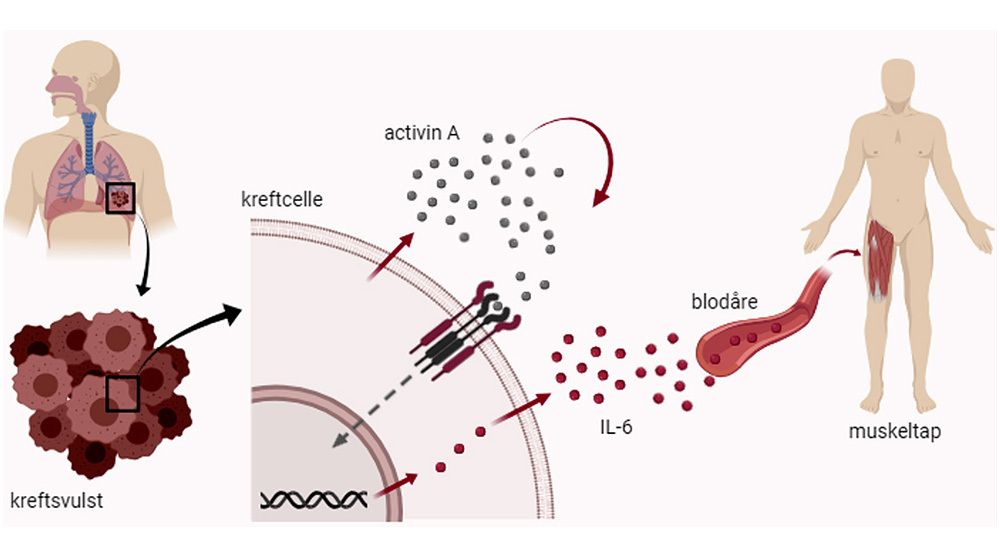
1. Først lager kreftcellene signalstoffet activin A. Dette skiller de ut. Activin A kan så ha en effekt på de samme kreftcellene ved at såkalte reseptorer på overflaten av kreftcellene i svulsten gjenkjenner og fanger opp dette signalstoffet.


2. Når activin A er bundet til overflaten av kreftcellene, setter disse cellene i gang med å produsere store mengder av signalstoffet IL-6. Deretter blir IL-6 sendt ut.
3. IL-6 virker på mange ulike måter, men én måte er at signalstoffet binder seg til muskelceller og gir dem beskjed om å bryte seg ned.
Nedbrytning normalt…
Så hvorfor gjør kreftcellene dette? Vel, egentlig øker de bare hastigheten på noe som allerede foregår. Kreftcellene trenger næringen som frigjøres ved at muskelcellene bryter ned proteiner, og de misbruker derfor en mekanisme vi allerede har i oss.
Denne nedbrytningen er nemlig en helt normal prosess. Cellene i kroppen bryter ned og bygger opp cellekomponenter hele tiden. Dette er viktig for å holde alle cellene våre funksjonelle.
Alle celler i kroppen inneholder mange små blærer med fordøyelses-enzymer. Disse blærene (lysosomer) tar opp og degraderer cellekomponenter i en prosess som kalles «autofagi», fritt oversatt «selvspising».
– Autofagi er viktig for alle celler og brukes til å bryte ned skadet eller overflødig celleinnhold. Prosessen kan også øke om vi får en periode der det er dårlig med mat. Autofagi frigjør aminosyrer, fett og sukker fra de nedbrutte cellekomponentene og gir byggesteiner for nye bio-molekyler eller til cellens energiproduksjon. På denne måten er autofagi en viktig mekanisme for å overleve sult i alle celler i alle organismer fra sopp til pattedyr, sier Pettersen.
…men ikke hastigheten
Byggesteinene som cellene våre består av, brytes altså ned og kan brukes på nye steder der det er bruk for dem akkurat nå.
Muskelcellene våre inneholder mye av enkelte proteiner som de kan justere mengden på uten at det går utover cellenes funksjon. Når litt av disse muskel-proteinene brytes ned, frigjøres det aminosyrer som muskelcella kan bruke selv eller som den kan skille ut i blodet til nytte for andre celler i kroppen.
Du tåler for eksempel normalt at musklene i armene eller beina dine svekkes en smule, i hvert fall om det fører til at hjertet og lungene dine virker som de skal.
– Nedbrytningen økes bare bittelitt på grunn av kreftcellene, påpeker senioringeniør Andersen.
Men dermed forrykkes balansen mellom nedbrytningen og oppbyggingen. Over tid fører den lille økningen i nedbrytningen til at du totalt sett mister muskelmasse.

Klimaomstilling i havnene krever mer strøm og kloke ideer
Kan være mer komplisert
Hos kreftpasienter med kakeksi er det sånn at om du får fjernet kreften, fjernes også kakeksien og musklene blir gjendannet. Dessverre lar ikke alle kreftsvulster seg fjerne med behandlingsmetodene vi har i dag, enten fordi kreften har spredd seg, ligger kinkig til eller fordi kreftbehandlingen ikke virker skikkelig.
Forskningsgruppa ved NTNU har vist at ved å hindre kreftcellene i å produsere activin A, eller hindre activin A i å binde seg til kreftcellene, begrenses også produksjonen av IL-6. Da blir ikke kreftcellene like effektive til å øke autofagi i andre celler. Hos kreftsyke mus har dette hindret dem fra å utvikle kakeksi, sier postdoktor Pettersen. Men vi vet ikke om det samme skjer i mennesker. Hos pasienter kan bildet være mer komplisert.
– Andre signalstoffer og prosesser kan også være involvert i å stimulere den økte nedbrytningen av muskelcellene, og det er ikke sikkert at alle typer kreft som gir kakeksi benytter seg av de samme signalstoffene, påpeker professor Bjørkøy.
– Det kan også tenkes at det er forskjell mellom enkeltpasienter selv om de i utgangspunktet har samme type kreft, sier senioringeniør Andersen.
– Vi mener jo at de to signalstoffene vi her har funksjonelt koblet til hverandre ofte er involvert, men det er viktig å fortsette letingen også etter andre kandidater, understreker postdoktor Pettersen.
.jpg)
Edderkoppene som spiser stjerner – og forskerne som fanger dem
Videre forskning
Selv om dette arbeidet har bidratt til å nøste litt opp i kakeksi-floken, og funnet en sammenheng mellom to viktige signalstoffer, trengs det videre forskning for å få et enda mer fullstendig bilde. Håpet er å finne ut om de typiske kreftformene som gir kakeksi, slik som lunge-, bukspyttkjertel- og tarmkreft, kontrollerer muskeltapet via helt egne eller felles mekanismer.
Målet er å utvikle tester hvor mengden eller aktiviteten av de aktuelle signalstoffene måles, for å kunne gi pasientene en skreddersydd behandling slik at muskeltapet blokkeres.
Allerede i dag er det dokumenterte tilfeller hvor enkeltpasienter med kakeksi har hatt stor nytte av et legemiddel som reduserer effekten av IL-6. Dette legemiddelet brukes i dag mot revmatisme. Forskere i utlandet planlegger nå klinisk utprøving av det samme legemiddelet i kreftpasienter med kakeksi.
– Derfor er det grunn til optimisme for at vi snart kan ha biologiske legemidler som kan bremse denne alvorlige komplikasjonen av kreft, sier professor Bjørkøy.
Likevel er det et stykke frem i tid før vi får avklart hvordan dette vil virke i pasienter og hvor mange av pasientene som kan hjelpes med legemiddelet som nå testes ut.
Langvarig samarbeid
De nye funnene er et resultat av mange års arbeid. Professor Bjørkøy sier prosjektet ved NTNU har pågått i ti år, men at ideene om denne formen for muskelnedbrytning og prosessene bak kreft-kakeksi kom lenge før den tid.
Arbeidet er gjort i nært samarbeid mellom blant annet Institutt for Bioingeniørfag ved NTNU, Senter for Molekylær Inflammasjonsforskning (CEMIR) ved NTNU og bioteknologiselskapet Novartis i Sveits. Novartis har interesse i prosjektet fordi vi kan utvide forståelsen av sykdomsmekanismen. Dermed kan det åpnes for nye angrepspunkter for behandlingsmetoder mot kakeksi. Bjørkøy fullroser det gode samarbeidet mellom partnerne.
Kilde: Journal of Cachexia, Sarcopenia and Muscle (2019). Autocrine activin A signalling in ovarian cancer cells regulates secretion of interleukin 6, autophagy, and cachexia. Kristine Pettersen, Sonja Andersen, Anna van der Veen, Unni Nonstad, Shinji Hatakeyama, Christian Lambert, Estelle Lach-Trifilieff, Siver Moestue, Jana Kim, Bjørn Henning Grønberg, Alain Schilb, Carsten Jacobi & Geir Bjørkøy. DOI: 10.1002/jcsm.12489

Krever full stans i jernbaneutbyggingen gjennom Moss